
获取有关法规变化和指南的最新消息
获取有关法规变化和指南的最新消息
基于您选择的市场和频率,接收电子邮件通知以了解最新的变化。
法规专家快速提供来自全球各地的洞察信息,以及相关文件或新闻的直达链接。

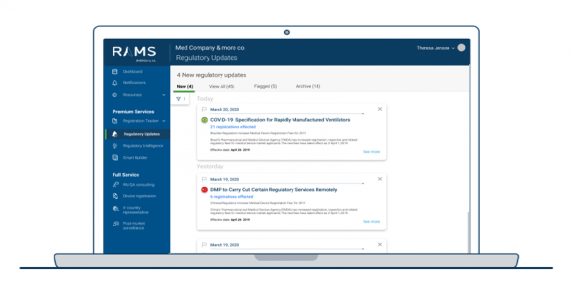
查找与您的器械、IVD或产品相关的更新
查找与您的器械、IVD或产品相关的更新
访问全球各地的所有更新,或根据您的目标市场筛选推送给您的结果。
按照法规变化的发布日期范围或生效日期进行筛选。
整理您的更新以计划未来的行动
整理您的更新以计划未来的行动
针对短期行动或长期业务计划自定义更新推送。
删除不需要的项目,标记重要更新以提醒自己采取行动,或者将项目存档供以后查看。
准备好进行下一步了吗?开始享受您的30天免费试用。
准备好进行下一步了吗?开始享受您的30天免费试用。
准备好进行下一步了吗?开始享受您的30天免费试用。
准备好进行下一步了吗?开始享受您的30天免费试用。